Primary tabs
Исследования на морской экспериментальной станции МЭС "о. Попова" (Жуковская)
- изучение механизмов токсичности фрагментов пластика (полистерол) на биохимическую систему адаптации у морских беспозвоночных.
- продолжение исследований по изучению особенности жирнокислотного (ЖК) состава митохондриальной фракции жабр у трех видов сем. Pectinidae, имеющих разную продолжительность жизни - Mizuhopecten yessoensis, Swiftopecten swiftii, Azumapecten farreri.
- проанализировать связь ЖК состава с максимальной продолжительностью жизни.
- сравнение с результатами прошлогодних исследований, выполненных на представителях сем. Mitilidae
- ежегодный мониторинг заселения рифовых конструкций подвижными и прикрепленными формами донных беспозвоночных, а также оценка и выявление сезонных изменений в количественных характеристиках сообщества гидробионтов.
- ежегодный мониторинг околорифового пространства – донной и пелагической зон.
1.Биохимические исследования
1.1. Изучение механизмов токсичности фрагментов пластика (полистерол) на биохимическую систему адаптации у морских беспозвоночных.
В результате эксперимента было установлено, что уровень ИАА в клетках пищеварительной железы у обоих видов исследованных моллюсков снизился после контакта с пенополистеролом (рис. 1В).
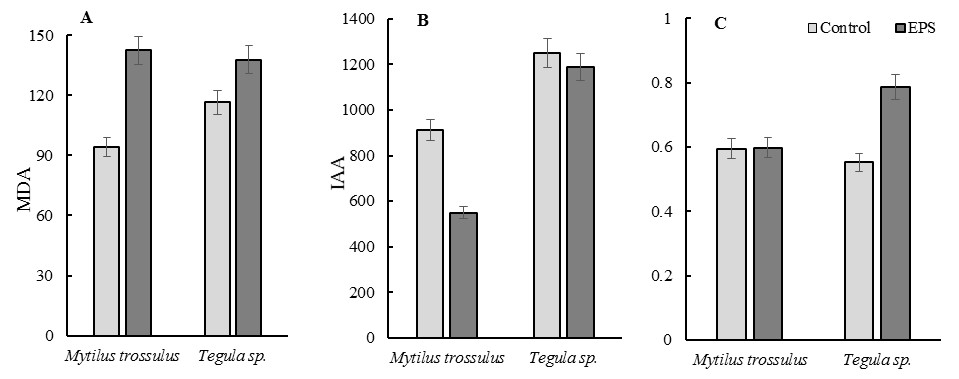
Рис.1. Уровень МДА (А), ИАА (В), и карбонилов (С) в клетках пищеварительной железы у обоих видов исследованных моллюсков.
Отмечено, что у T. rustica уровень ИАА снизился незначительно, при этом достоверных отличий не обнаружено. В клетках пищеварительной железы экспериментальных мидий данный показатель опустился более чем в 1,5 раза по сравнению с контролем, что свидетельствует о снижение активности низкомолекулярного звена АО системы и в выраженном токсическом воздействии с развитием окислительного стресса в организме.
Продукты окисления (малоновый диальдегид и карбонилы)
При анализе уровня МДА в пищеварительной железе у M. trossulus и T. rustica было установлено, что в результате воздействия пенополистерола его концентрация значительно увеличилась (рис. 1А).
При воздействии пенополистерола отмечен рост уровня МДА (Рис. 1А), так в пищеварительной железе мидий он сотавил 142,5 мкмоль / г сыр. веса, который отличался от контроля (84,2 мкмоль / г сыр. веса) более чем в 1,5 раза. У тегулы, увеличение концентрации МДА было несколько ниже, чем у мидий, примерно в 1,2 раза. Полученные данные могут свидетельствовать о том, что моллюски, подверженные воздействию пенополистерола, находились в состоянии выраженного окислительного стресса.
В процессе исследования установлено, что пенополистерол не вызывал увеличения концентрации окисленных форм белков в пищеварительной ткани мидии (рис. 1С). Однако было выявлено, что у тегулы этот показатель достоверно увеличился по сравнению с контролем практически в 1,5 раза.
Повреждение структуры ДНК.
Анализ целостности молекулы ДНК клеток пищеварительной железы после пребывания моллюсков в аквариуме с пенополистеролом показал, что у M. trossulus и T. rustica происходило достоверное увеличение уровня повреждения ДНК (Рис. 2).
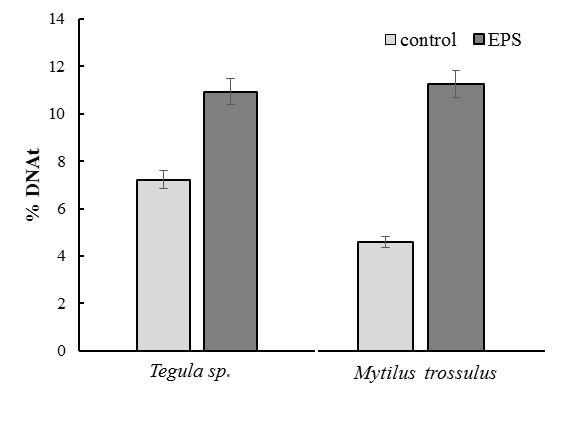
Рис. 2. Повреждение ДНК в ответ на действие пенополистерола у исследуемых моллюсков.
В клетках пищеварительной железы у M. trossulus количество ДНК в хвосте кометы увеличилось практически в 2,5 раза у T. rustica в 1,5 раза относительно контрольных значений.
1.2. Исследования по изучению по изучению жирнокислотного (ЖК) состава митохондриальной фракции жабр у трех видов сем. Pectinidae, имеющих разную продолжительность жизни - Mizuhopecten yessoensis, Swiftopecten swiftii, Azumapecten farreri.
Согласно результатам хромато-масс-спектрометрического анализа, представленного в таблице 1, качественный состав жирных кислот липидов митохондрий клеток жабр единообразен (не различается) у всех исследованных нами видов морских моллюсков независимо от их продолжительности жизни. Тогда как по количественному содержанию индивидуальных ЖК липиды митохондрий моллюсков существенно различались. У представителей семейства Pectinidae в составе жирных кислот липидов мембран митохондрий клеток жабр доминировали полиненасыщенные кислоты (ПНЖК), количество которых было больше чем сумма НЖК и МНЖК.
На основе состава жирных кислот в соответствии с формулой, приведенной в работе (Munro and Blier, 2012), был рассчитан индекс окисляемости липидов, значения которого приведены в таблице 2. Из анализа этих значений следует, что склонность к окислению ЖК липидов мембран митохондрий у представителей пектинид выше, чем у представителей мидиевых.
Базовый уровень АФК, МДА и карбонилов
Базовые уровни генерации АФК и содержания МДА в митохондриях оказались самыми высокими у долгоживущих моллюсков мидии Грэя C. grayanus и приморского гребешка M. yessoensis, по сравнению со средне- и короткоживущими представителями соответствующих семейств. В целом, представители семейства мидиевых отличались от представителей семейства пектинид более низким уровнем генерации АФК и более высоким содержанием МДА в митохондриях клеток жабр. Межвидовых различий в содержании карбонилов белков у всех исследованных моллюсков не выявлено (рис. 3 А).
Индукция in vitro окислительного стресса
Результаты этой серии экспериментов показали, что при инициировании свободно-радикальных процессов с помощью реакции Фентона, наименьший уровень образования радикалов кислорода зарегистрирован был в митохондриях долгоживущих моллюсков мидии Грэя C. grayanus и приморского гребешка M. yessoensis в отличие от короткоживущих M. trossulus и A. farreri nipponensis (Рис. 3 В). Аналогичная картина наблюдалась и в образовании основного продукта окислительного распада липидов – МДА.
Предварительный анализ результатов показывает Общие черты взаимосвязи ЖК состава мембран митохондрий жабр с МПЖ видов. Эти черты выявляются только при сравнительном анализе моллюсков, имеющих общее происхождение (в пределах семейства). Реакция на индуцированный in vitro окислительный стресс также имеет связь с МПЖ видов, относящихся к одному семейству.
Базовый уровень образования АФК и МДА в митохондриях жабр выше у долгоживущих моллюсков C. grayanus и M. yessoensis по сравнению с средне- и короткоживущими представителями соответствующих семейств, при этом мембраны митохондрий жабр этих видов более устойчивы к вызванному in vitro окислительному стрессу (низкий уровень АФК и МДА).
Вероятно, что важным механизмом поддержания долгожительства у C. grayanus и M. yessoensis является особый ЖК состав мембран митохондрий, который характеризуется более низким соотношением НЖК/ПНЖК, а также n-3/n-6, и более высоким соотношением суммы ЖК с 2 и 3 связями и суммы ЖК с 4 и 6 связями, а также более высоким содержанием суммы НМРЖК по сравнению с средне- и короткоживущими видами соответствующего семейства.
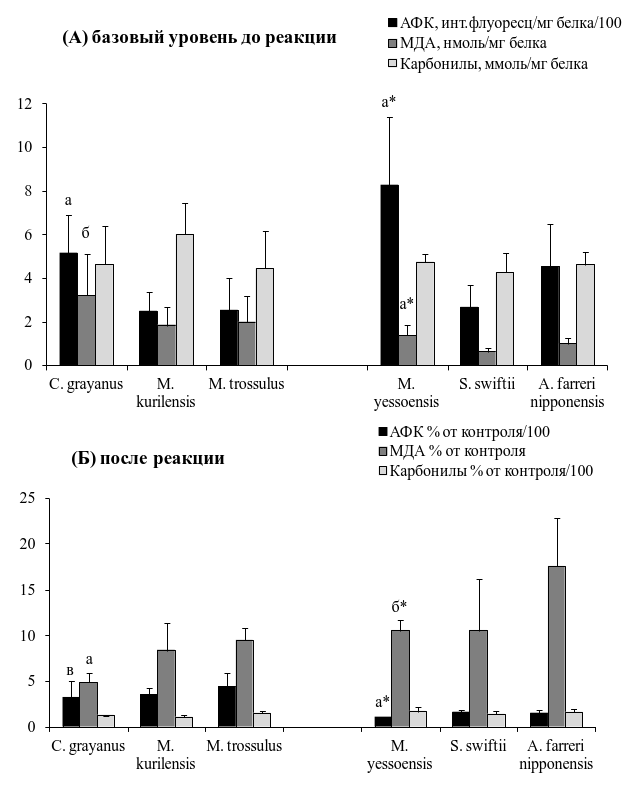
Рис. 3. (А) - Базовый уровень АФК (активных форм кислорода), МДА (малонового диальдегида) и карбонилов в митохондриях жабр моллюсков; (Б) -Реакция на вызванный окислительный стресс in vitro.
| Жирная кислота |
Mytilidae |
Pectinidae |
||||
|
Crenomytilus grayanus |
Modiolus kurilensis |
Mytilus trossulus |
Mizuhopecten yessoensis |
Swiftopecten swiftii |
Azumapecten farreri nipponensis |
|
|
|
|
|
|
|
|
|
| 12:0 |
1.0 ± 0.0 |
0.7 ± 0.2 |
1.1 ± 0.1 |
0.7 ± 0.0 |
0.7 ± 0.2 |
1.0 ± 0.7 |
| 14:0 ai |
0.2 ± 0.0 |
0.7 ± 0.1 |
0.8 ± 0.0 |
0.5 ± 0.0 |
0.3 ± 0.1 |
0.8 ± 0.2 |
| 14:0 |
0.6 ± 0.0 |
0.3 ± 0.1 |
0.7 ± 0.0 |
0.1 ± 0.0 |
0.4 ± 0.1 |
0.1 ± 0.0 |
| 15:1n-7 |
1.0 ± 0.0 |
1.8 ± 0.0 |
1.6 ± 0.3 |
0.4 ± 0.0 |
0.4 ± 0.1 |
0.6 ± 0.0 |
| 16:0 |
17.9 ± 0.9 |
15.9 ± 0.3 |
19.0 ± 0.1 |
12.5 ± 0.6 |
12.7 ± 0.8 |
13.7 ± 0.7 |
| 16:1 n-9 |
2.1 ± 0.1 |
2.0 ± 0.5 |
2.7 ± 0.3 |
1.3 ± 0.0 |
- |
2.2 ± 0.2 |
| 16:1 n-7 |
2.3 ± 0.1 |
2.3 ± 0.1 |
1.9 ± 0.0 |
1.4 ± 0.0 |
2.3 ± 0.5 |
1.2 ± 0.0 |
| 17:0 i |
0.6 ± 0.0 |
0.5 ± 0.0 |
0.5 ± 0.0 |
0.3 ± 0.0 |
0.9 ± 0.1 |
0.1 ± 0.0 |
| 17:0 ai |
1.1 ± 0.1 |
1.8 ± 0.1 |
1.8 ± 0.0 |
1.2 ± 0.0 |
0.3 ± 0.1 |
2.3 ± 0.0 |
| 17:0 |
0.8 ± 0.0 |
1.9 ± 0.1 |
1.7 ± 0.0 |
1.0 ± 0.0 |
0.9 ± 0.2 |
- |
| 18:0 i |
2.8 ± 0.1 |
2.5 ± 0.2 |
4.0 ± 0.1 |
0.9 ± 0.0 |
1.2 ± 0.3 |
1.3 ± 0.1 |
| 18:0 |
9.6 ± 0.5 |
10.9 ± 0.3 |
19.8 ± 3.1 |
4.8 ± 0.2 |
3.3 ± 0.6 |
9.7 ± 0.1 |
| 18:1 n-9 |
0.7 ± 0.0 |
- |
- |
- |
0.1± 0.1 |
1.0 ± 0.0 |
| 18:1n-7 |
4.3 ± 0.2 |
5.1 ± 0.3 |
2.3 ± 1.6 |
4.3 ± 0.2 |
4.5 ± 0.4 |
5.4 ± 0.4 |
| 18:2 n-6 |
1.0 ± 0.0 |
2.4 ± 0.5 |
1.6 ± 0.3 |
2.0 ± 0.1 |
2.2 ± 0.2 |
2.5 ± 0.1 |
| 18:2 n-4 |
0.4 ± 0.0 |
1.5 ± 1.5 |
0.5 ± 0.2 |
0.6 ± 0.0 |
0.1 ± 0.0 |
0.3 ± 0.1 |
| 18:3 n-6 |
- |
- |
0.2 ± 0.0 |
0.2 ± 0.0 |
0.2 ± 0.0 |
- |
| 18:3 n-3 |
0.8 ± 0.0 |
1.2 ± 0.0 |
0.3 ± 0.0 |
0.3 ± 0.0 |
0.2 ± 0.0 |
0.1 ± 0.0 |
| 20:0-i |
1.8 ± 0.1 |
1.7 ± 0.1 |
0.4 ± 0.1 |
- |
- |
0.8 ± 0.1 |
| 18:4 n-3 |
0.2 ± 0.0 |
- |
0.4 ± 0.0 |
- |
0.1 ± 0.0 |
- |
| 20:1 n-13 |
2.2 ± 0.1 |
0.6 ± 0.1 |
0.8 ± 0.2 |
2.0 ± 0.1 |
1.8 ± 0.0 |
2.9 ± 0.1 |
| 20:1 n-9 |
5.8 ± 0.3 |
3.4 ± 0.1 |
1.9 ± 0.3 |
5.5 ± 0.3 |
4.2 ± 0.5 |
4.2 ± 0.2 |
| 20:1 n-7 |
2.2 ± 0.1 |
3.9 ± 0.0 |
1.3 ± 0.2 |
1.0 ± 0.1 |
0.6 ± 0.3 |
2.5 ± 0.1 |
| 20:2 (5,11) |
3.9 ± 0.2 |
1.9 ± 0.0 |
1.8 ± 0.1 |
5.4 ± 0.3 |
5.5 ± 0.6 |
0.9 ± 0.0 |
| 20:2 (5,13) |
1.6 ± 0.1 |
0.6 ± 0.1 |
1.1 ± 0.2 |
1.7 ± 0.1 |
1.0 ± 0.1 |
0.7 ± 0.1 |
| 20:4 n-6 |
5.5 ± 0.3 |
5.7 ± 0.5 |
3.5 ± 0.3 |
6.7 ± 0.3 |
5.8 ± 1.2 |
3.9 ± 0.2 |
| 20:5 n-3 |
4.2 ± 0.2 |
6.2 ± 0.5 |
6.0 ± 0.4 |
3.9 ± 0.2 |
4.7 ± 0.6 |
9.7 ± 0.3 |
| 22:2 (НМРЖК) |
8.2 ± 0.4 |
5.2 ± 0.1 |
4.1 ± 0.2 |
11.7 ± 0.6 |
9.0 ± 1.2 |
1.0 ± 0.0 |
| 22:6 n-3 |
8.6 ± 0.4 |
9.7 ± 0.3 |
9.3 ± 0.4 |
22.1 ± 1.1 |
25.8 ± 1.4 |
21.7 ± 1.3 |
| всего |
91.1 ± 4.6 |
90.4 ± 0.9 |
87.4 ± 4.0 |
93.6 ± 4.7 |
89.5 ± 7.2 |
92.0 ± 1.3 |
|
|
|
|
|
|
|
|
| НЖК |
36.3 ± 1.8 |
37.0 ± 0.0 |
47.8 ± 0.5 |
22.36 ± 1.1 |
21.0 ± 1.9 |
30.3 ± 1.4 |
| МНЖК |
20.5 ± 1.0 |
19.0 ± 1.0 |
11.4 ± 3.1 |
16.12 ± 0.8 |
13.4 ± 0.4 |
20.4 ± 0.6 |
| ПНЖК |
34.3 ± 1.7 |
34.4 ± 0.1 |
28.2 ± 1.4 |
55.13 ± 2.8 |
55.0 ± 4.9 |
43.6 ± 5.7 |
| ∑n-3 |
13.6 ± 0.7 |
17.1 ± 0.8 |
15.4 ± 1.0 |
26.55 ± 1.3 |
30.8 ± 1.9 |
31.6 ± 1.6 |
| ∑n-6 |
6.5 ± 0.3 |
8.1 ± 1.0 |
5.2 ± 0.4 |
9.03 ± 0.5 |
8.3 ± 1.5 |
6.4 ± 0.4 |
|
|
|
|
|
|
|
|
|
n-3/n-6 |
2.10 |
2.11 |
2.98 |
2.94 |
3.69 |
4.92 |
|
НЖК/ ПНЖК |
1.05 |
1.08 |
1.70 |
0.41 |
0.38 |
0.70 |
|
∑НМРЖК |
13.7 ± 0.01 |
7.75 ± 0.24 |
6.93 ± 0.15 |
18.9 ± 0.1 |
15.68 ± 1.63 |
2.76 ± 0.22 |
|
∑2n, 3n/ ∑ 4n, 6n |
1.11 |
0.84 |
0.73 |
0.77 |
0.58 |
0.22 |
|
PI
|
124.5 ± 6.2 |
146.7 ± 6.6 |
129.7 ± 7.9 |
238.2 ± 11.2 |
267.3 ± 19.5 |
252.7 ± 13.6 |
|
МПЖ |
150 |
61 |
6 |
22 |
15 |
9 |
Таблица 1. Процентное содержание жирных кислот (от суммы жирных кислот) в митохондриях жабр двустворчатых моллюсков (среднее ± стандартное отклонение, n=2).
Примечание: МПЖ – максимальная продолжительность видов; PI – индекс перекисного окисления; НЖК – насыщенные жирные кислоты; МНЖК – мононенасыщенные жирные кислоты; ПНЖК полиненасыщенные жирные кислоты; НМРЖК – неметиленразделенные жирные кислоты
2.Гидробиологические работы (Предварительные результаты):
2.1. Искусственные рифы.
2.1.1Краткая характеристика обрастаний ИР-1 и состояние биотопа вокруг установки в октябре 2023 г.
Большое наличие органической взвеси в толще воды в районе ИР-1 в октябре месяце делает затруднительным описание и характеристику обрастания. Однако по первой, предварительной оценке можно отметить крупные объекты бентоса в донном сообществе, а также среди организмов-обрастателей поверхности ИР (Рис. 6). На глубине 9 м в центральной части б. Алексеева вблизи ИР №1 наблюдается илисто-песчаный грунт с примесью пустых раковин двустворчатых и брюхоногих моллюсков, фрагментами листовых пластин морской травы Zostera marina, Ulva fenistrata. Среди организмов эпибентоса преобладают хищные морские звезды Patiria pectinifera (более 10 экз./м2), приморский гребешок Mizuhopecten yessoensis (1 экз./м2), серый морской еж Strongylocentrotus intermedius (1-2 экз./м2), единично отмечен черный морской еж Mesocentrotus nudus. На поверхности осадка присутствуют офиуры Amphipholis kochii (до 5 экз./м2), молодь морской звезды Asterias amurensis (1 экз./м2).
На дне участка исследования местами можно наблюдать бетонные плиты, покрытые слоем обводненного подвижного наилка, богатого органическим детритом. Осевшими на поверхность плит неразложенными частицами растительных и животных организмов питаются офиуры, морские ежи, полихеты и другие донные беспозвоночные. К организмам-обрастателям бетонных конструкций можно отнести немногочисленных усоногих раков, мелких многощетинковых червей рода Spirorbis со спиральными известковыми трубками и колониями гладких известковых трубок полихет рода Serpula.

Рис. 6. Приморский гребешок и скопление морских звезд патирий на заиленном участке дна вблизи ИР-1

Рис.7. Черный и серый морские ежи, морские звезды Patiria pectenifera, молодь морской звезды Asterias amurensis

Рис.8. Серый морской еж, многочисленные усоногие раки в известковых домиках, морские губки в сообществе обрастаний поверхности стенки ИР-1

Рис. 9. Морская звезда Asterias amurensis, устрица тихоокеанская, известковые трубки полихеты Hydroides ezoensis, редкие Balanus rostratus на поверхности стенки ИР-1

Рис.10. Колонии взрослых особей и молоди усоногих раков на поверхности стенки ИР-1

Рис. 11. Коралловые полипы Obelia longimissima, морские губки, мшанки, корковые водоросли, известковые трубки полихет на участках ИР-1
2.1.2Краткая характеристика обрастаний ИР-2 и состояние биотопа вокруг установки в ноябре 2023 г.
На участке дна вокруг ИР-2 в ноябре 2023 г. наблюдает относительная прозрачность воды по сравнению с октябрем этого же года (Рис. 12 - 17).
В районе ИР-2 наблюдаются скопления (друзы) митилид (мидия тихоокеанская, модиолус курильский, мидия Грея. В друзах наблюдаются обрастания усоногими раками Balanus rostratus. Поверхность некоторых раковин мидии покрыта корковыми водорослями.
На участке исследования грунт представлен заиленным мелким песком, со слоем подвижного наилка толщиной 1 см. Рельеф имеет мозаичный характер распределения биоты и следов жизнедеятельности животных. Уклон незаметный, грунт с разобщенным биоподвижным скелетом. Облик подводной местности напоминает веррукоид (Арзамасцев, 1990) – дно покрыто хаотично расположенными друзами («клумбами») мидий. В составе эпифауны присутствует ценный охраняемый представитель голотурий – дальневосточный трепанг Apostichopus japonicus (до 0,1 экз./м2). На поверхности илистого осадка местами можно наблюдать скопления спиралевидных экскретов – следы жизнедеятельности трепанга.

Рис. 12. Дальневосточный трепанг, серый и черный морские ежи, друза мидий, морская звезда на дне, покрытом подвижным наилком

Рис.13. Друза мидии тихоокеанской, клювоносный морского желудя, модиолуса курильского. Рядом с друзой – экскреты гидробионтов, серый морской еж, звезда – патирия
Поверхность (стенка шхуны) установки ИР-2 плотно покрыта организмами обрастателями. В составе отмечены Balanus rostratus, гидроиды Obelia longimissima, морские губки, корковые водоросли Lithothamnion sonderi, Bossiella compressa, многочисленные известковые трубки полихет Neodexiospira alveolata, Hydroides ezoensis, Serpula sp. На канатах отмечены асцидии Styela clava и гидроиды Obelia longimissima, значительно реже отмечены асцидии Ciona savignyi.
Среди крупных подвижных организмов эпибентоса можно наблюдать морских звезд Asterias amurensis, Patiria pectenifera, серого и черного морских ежей Strongylocentrotus intermedius и Mesocentrotus nudus. Деревянные поверхности шхуны покрыты слоем детрита (местами до 1 см).
Единично отмечен опистоцентр опоясанный Opisthocentrus zonope – мелкая донная рыба, максимальная длина которой составляет 12 см. Держится на каменистых грунтах, илистом песке среди водорослей, губок, гидроидов и мшанок. (Соколовский и др., 2011).

Рис. 14. Плотные обрастания стенки ИР-2 усоногими раками. Асцидии и гидроиды в обрастании каната

Рис.15. Серый и черный морские ежи, морские звезды астерия и патирия на участке затопленной шхуны

Рис.16. Patiria pectenifera, Strongylocentrotus intermedius на покрытой детритом деревянной поверхности шхуны, Opisthocentrus zonope в толще воды

Рис. 17. Обрастания канатов многочисленными гидроидными полипами Obelia longimissima и редкими асцидиями Ciona savignyi